ЭДС. Закон Ома для полной цепи
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: электродвижущая сила, внутреннее сопротивление источника тока, закон Ома для полной электрической цепи
До сих пор при изучении электрического тока мы рассматривали направленное движение свободных зарядов во внешней цепи, то есть в проводниках, подсоединённых к клеммам источника тока.
Как мы знаем, положительный заряд :
• уходит во внешнюю цепь с положительной клеммы источника;
• перемещается во внешней цепи под действием стационарного электрического поля, создаваемого другими движущимися зарядами;
• приходит на отрицательную клемму источника, завершая свой путь во внешней цепи.
Теперь нашему положительному заряду нужно замкнуть свою траекторию и вернуться на положительную клемму. Для этого ему требуется преодолеть заключительный отрезок пути — внутри источника тока от отрицательной клеммы к положительной.
Но вдумайтесь: идти туда ему совсем не хочется! Отрицательная клемма притягивает его к себе, положительная клемма его от себя отталкивает, и в результате на наш заряд внутри источника действует электрическая сила , направленная против движения заряда (т.е.
против направления тока).
Сторонняя сила
Тем не менее, ток по цепи идёт; стало быть, имеется сила, «протаскивающая» заряд сквозь источник вопреки противодействию электрического поля клемм (рис. 1).
Рис. 1. Сторонняя сила
Эта сила называется сторонней силой; именно благодаря ей и функционирует источник тока. Сторонняя сила не имеет отношения к стационарному электрическому полю — у неё, как говорят, неэлектрическое происхождение; в батарейках, например, она возникает благодаря протеканию соответствующих химических реакций.
Обозначим через работу сторонней силы по перемещению положительного заряда q внутри источника тока от отрицательной клеммы к положительной. Эта работа положительна, так как направление сторонней силы совпадает с направлением перемещения заряда. Работа сторонней силы называется также работой источника тока.
Во внешней цепи сторонняя сила отсутствует, так что работа сторонней силы по перемещению заряда во внешней цепи равна нулю. Поэтому работа сторонней силы по перемещению заряда вокруг всей цепи сводится к работе по перемещению этого заряда только лишь внутри источника тока. Таким образом, — это также работа сторонней силы по перемещению заряда по всей цепи.
Мы видим, что сторонняя сила является непотенциальной — её работа при перемещении заряда по замкнутому пути не равна нулю. Именно эта непотенциальность и обеспечивает циркулирование электрического тока; потенциальное электрическое поле, как мы уже говорили ранее, не может поддерживать постоянный ток.
Опыт показывает, что работа прямо пропорциональна перемещаемому заряду . Поэтому отношение уже не зависит от заряда и является количественной характеристикой источника тока. Это отношение обозначается :
(1)
Данная величина называется электродвижущей силой (ЭДС) источника тока. Как видим, ЭДС измеряется в вольтах (В), поэтому название «электродвижущая сила» является крайне неудачным. Но оно давно укоренилось, так что приходится смириться.
Когда вы видите надпись на батарейке: «1,5 В», то знайте, что это именно ЭДС. Равна ли эта величина напряжению, которое создаёт батарейка во внешней цепи? Оказывается, нет! Сейчас мы поймём, почему.
Закон Ома для полной цепи
Любой источник тока обладает своим сопротивлением , которое называется внутренним сопротивлением этого источника. Таким образом, источник тока имеет две важных характеристики: ЭДС и внутреннее сопротивление.
Пусть источник тока с ЭДС, равной , и внутренним сопротивлением подключён к резистору (который в данном случае называется внешним резистором, или внешней нагрузкой, или полезной нагрузкой). Всё это вместе называется полной цепью (рис. 2).
Рис. 2. Полная цепь
Наша задача — найти силу тока в цепи и напряжение на резисторе .
За время по цепи проходит заряд . Согласно формуле (1) источник тока совершает при этом работу:
(2)
Так как сила тока постоянна, работа источника целиком превращается в теплоту, которая выделяется на сопротивлениях и . Данное количество теплоты определяется законом Джоуля–Ленца:
(3)
Итак, , и мы приравниваем правые части формул (2) и (3):
После сокращения на получаем:
Вот мы и нашли ток в цепи:
(4)
Формула (4) называется законом Ома для полной цепи.
Если соединить клеммы источника проводом пренебрежимо малого сопротивления , то получится короткое замыкание. Через источник при этом потечёт максимальный ток — ток короткого замыкания:
Из-за малости внутреннего сопротивления ток короткого замыкания может быть весьма большим. Например, пальчиковая батарейка разогревается при этом так, что обжигает руки.
Зная силу тока (формула (4)), мы можем найти напряжение на резисторе с помощью закона Ома для участка цепи:
(5)
Это напряжение является разностью потенциалов между точками и (рис. 2). Потенциал точки равен потенциалу положительной клеммы источника; потенциал точки равен потенциалу отрицательной клеммы. Поэтому напряжение (5) называется также напряжением на клеммах источника.
Мы видим из формулы (5), что в реальной цепи будет — ведь умножается на дробь, меньшую единицы. Но есть два случая, когда .
1. Идеальный источник тока. Так называется источник с нулевым внутренним сопротивлением. При формула (5) даёт .
2. Разомкнутая цепь. Рассмотрим источник тока сам по себе, вне электрической цепи. В этом случае можно считать, что внешнее сопротивление бесконечно велико: . Тогда величина неотличима от , и формула (5) снова даёт нам .
Смысл этого результата прост: если источник не подключён к цепи, то вольтметр, подсоединённый к полюсам источника, покажет его ЭДС.
Кпд электрической цепи
Нетрудно понять, почему резистор называется полезной нагрузкой. Представьте себе, что это лампочка. Теплота, выделяющаяся на лампочке, является полезной, так как благодаря этой теплоте лампочка выполняет своё предназначение — даёт свет.
Количество теплоты, выделяющееся на полезной нагрузке за время , обозначим .
Если сила тока в цепи равна , то
Некоторое количество теплоты выделяется также на источнике тока:
Полное количество теплоты, которое выделяется в цепи, равно:
Кпд электрической цепи — это отношение полезного тепла к полному:
КПД цепи равен единице лишь в том случае, если источник тока идеальный .
Закон Ома для неоднородного участка
Простой закон Ома справедлив для так называемого однородного участка цепи — то есть участка, на котором нет источников тока. Сейчас мы получим более общие соотношения, из которых следует как закон Ома для однородного участка, так и полученный выше закон Ома для полной цепи.
Участок цепи называется неоднородным, если на нём имеется источник тока. Иными словами, неоднородный участок — это участок с ЭДС.
На рис. 3 и источник тока. ЭДС источника равна , его внутреннее сопротивление считаем равным нулю (усли внутреннее сопротивление источника равно , можно просто заменить резистор на резистор ).
Рис. 3. ЭДС «помогает» току:
Сила тока на участке равна , ток течёт от точки к точке . Этот ток не обязательно вызван одним лишь источником . Рассматриваемый участок, как правило, входит в состав некоторой цепи (не изображённой на рисунке), а в этой цепи могут присутствовать и другие источники тока. Поэтому ток является результатом совокупного действия всех источников, имеющихся в цепи.
Пусть потенциалы точек и равны соответственно и . Подчеркнём ещё раз, что речь идёт о потенциале стационарного электрического поля, порождённого действием всех источников цепи — не только источника, принадлежащего данному участку, но и, возможно, имеющихся вне этого участка.
Напряжение на нашем участке равно: . За время через участок проходит заряд , при этом стационарное электрическое поле совершает работу:
Кроме того, положительную работу совершает источник тока (ведь заряд прошёл сквозь него!):
Сила тока постоянна, поэтому суммарная работа по продвижению заряда , совершаемая на участке стационарным элетрическим полем и сторонними силами источника, целиком превращается в тепло: .
Подставляем сюда выражения для , и закон Джоуля–Ленца:
Сокращая на , получаем закон Ома для неоднородного участка цепи:
(6)
или, что то же самое:
(7)
Обратите внимание: перед стоит знак «плюс». Причину этого мы уже указывали — источник тока в данном случае совершает положительную работу, «протаскивая» внутри себя заряд от отрицательной клеммы к положительной. Попросту говоря, источник «помогает» току протекать от точки к точке .
Отметим два следствия выведенных формул (6) и (7).
1. Если участок однородный, то . Тогда из формулы (6) получаем — закон Ома для однородного участка цепи.
2. Предположим, что источник тока обладает внутренним сопротивлением . Это, как мы уже упоминали, равносильно замене на :
Теперь замкнём наш участок, соединив точки и . Получим рассмотренную выше полную цепь. При этом окажется, что и предыдущая формула превратится в закон Ома для полной цепи:
Таким образом, закон Ома для однородного участка и закон Ома для полной цепи оба вытекают из закона Ома для неоднородного участка.
Может быть и другой случай подключения, когда источник «мешает» току идти по участку. Такая ситуация изображена на рис. 4. Здесь ток, идущий от к , направлен против действия сторонних сил источника.
Рис. 4. ЭДС «мешает» току:
Как такое возможно? Очень просто: другие источники, имеющиеся в цепи вне рассматриваемого участка, «пересиливают» источник на участке и вынуждают ток течь против . Именно так происходит, когда вы ставите телефон на зарядку: подключённый к розетке адаптер вызывает движение зарядов против действия сторонних сил аккумулятора телефона, и аккумулятор тем самым заряжается!
Что изменится теперь в выводе наших формул? Только одно — работа сторонних сил станет отрицательной:
Тогда закон Ома для неоднородного участка примет вид:
(8)
или:
где по-прежнему — напряжение на участке.
Давайте соберём вместе формулы (7) и (8) и запишем закон Ома для участка с ЭДС следующим образом:
Ток при этом течёт от точки к точке . Если направление тока совпадает с направлением сторонних сил, то перед ставится «плюс»; если же эти направления противоположны, то ставится «минус».
Источник: https://ege-study.ru/ru/ege/materialy/fizika/eds-zakon-oma-dlya-polnoj-cepi/
Химические источники тока – где применяются, и каков принцип действия
Любая батарейка или аккумулятор дает ток за счет протекающих внутри них химических реакций
Химические источники тока (сокращенно ХИТ) – это источники электродвижущей силы (ЭДС), в которых в электрическую энергию превращается энергия протекающих внутри химических реакций. Используют их сегодня повсеместно – это и современные электромобили и портативная радиоэлектроника, и медицинское оборудование, и портативные компьютеры.
Все это делает источники тока электрохимические очень важным изобретением, которым пользуются вот уже 2-ю сотню лет. Именно про ХИТ мы подробно и поговорим в сегодняшней статье.
Классификация химических источников тока
Все ХИТ принято подразделять на три основные категории:
Как устроены гальванические батареи
- Первичные гальванические элементы – внутри таких источников происходят химические окислительно-восстановительные реакции, энергия которых и переходит в электрическую. Данные реакции являются необратимыми, поэтому элементы невозможно перезарядить.
- Состоят такие батареи из двух электродов, которые имеют разный электродный потенциал, металлического проводника, по которому могут перемещаться электроны, и электролита, который помогает перемещению ионов между электродами.
Интересно знать! Напомним, что именно поток электронов и приводит к возникновению электрического тока.
Вторичный химический источник тока
- Вторичные ХИТ, они же электрические аккумуляторы – тоже являются гальваническими элементами, однако их особенность заключается в том, что возможна перезарядка.
- В отличие от батарей, которые исчерпывают свою работоспособность при разряде, аккумуляторы могут регенерироваться, то есть повторно накапливать энергию и перезапускать цикл химических реакций.
- Возобновление заряда происходит при пропускании через элемент электрического тока, для чего нужна внешняя цепь. Все мы ежедневно заряжаем свои телефоны и смартфоны, ноутбуки и планшеты. Аккумуляторы применяются практически везде, и это не удивительно – их ресурс намного выше, чем у любой первичной батареи в сотни раз, при том, что цена больше до 10-ти раз.
- Прообраз первой аккумуляторной батареи был создан в далеком 1803 году немецким физиком-химиком И. Риттером. Его устройство имело в составе пятьдесят медных кружков, между которыми было проложено влажное сукно. Когда через него проходил ток от Вольтова столба, изделие само становилось источником электрического тока.
Топливный источник тока химический
- Последним типом химических источников тока являются топливные элементы, или электрохимические генераторы. Основное отличие их от гальванических элементов это то, что вещества необходимые для электрохимической реакции подаются внутрь извне, а продукты от реакций, наоборот, удаляются.
- Подобный подход позволяет организовать долгую непрерывную работу без фактической перезарядки.
- Впервые применять топливные источники тока стали во второй половине 20-го века, несмотря на то, что основные принципы функционирования были открыты в далеком 1839 году. В 1965 году их впервые задействовали в космической технике – это был элемент КК «Джемини». Его изначальное расчетное время работы составляло от суток, до 2-х месяцев. Эти элементы имели достаточное преимущество перед солнечными батареями с буферными химическими батареями в плане массы и габаритов, а также удельной мощности.
- Первая топливная батарея КК «Джемини» состояла из 3 блоков по 32 элемента, каждый из которых выдавал напряжение в 0,8В, и работала на газообразном топливе (кислород и водород).
Характеристики гальванических источников тока
Щелочные аккумуляторы и их свойства
Характеристика химических источников тока включает в себя следующие параметры:
Уравнение Нернста для электродного потенциала
- Электродвижущая сила – этот параметр гальванического элемента зависит от состава используемого электролита и типов металлов, из которых изготовлены электроды. Описывают ЭДС термодинамические функции (уравнение Нернста), приложенные к протекающим электрохимическим процессам.
Измеряется емкость обычно в миллиамперах в час
- Емкость элемента питания – тут все просто, имеется в виду количество энергии, которое элемент может отдать при разряде. Данный параметр напрямую зависит от массы запасенного в батарее реагентов и скорости их превращения. Емкость элемента будет снижаться, если элемент будет охлажден, либо вырастет ток разряда.
- Энергия гальванического элемента. Этот параметр высчитывается путем перемножения емкости на выдаваемое напряжение. Энергия будет уменьшаться по мере роста разрядного тока. Обратный эффект будет достигнут при росте температуры (до определенного уровня) и увеличении используемых реагентов.
Прототип гальванической батареи
- Сохраняемость – по сути, срок годности элемента, в течение которого он способен не менять своих основных характеристик в допустимых пределах.
Совет! Чем выше температура, тем быстрее сокращается срок хранения.
- Плотность энергии – количество запасенной энергии в расчете на единицу массы аккумулятора или его объема.
- Саморазряд первичного химического источника тока – очень важный параметр, указывающий на потерю емкости батареей без подключенной к ней нагрузки. То есть параметр фактически сопоставим со сроком службы элемента.
- Саморазряд химических источников тока вторичных, по сути, то же самое, однако этот параметр меняется во времени. Особенно высоко его значение после полной подзарядки аккумулятора, но по мере разрядки он ослабевает.
Интересно знать! Для никель-кадмиевых аккумуляторов, функционирующих исправно, не допускается потеря более 10% от максимального заряда за 1 сутки. Никель-металлгидридные имеют меньший показатель, а у литий-ионных этот эффект практически отсутствует, растягиваясь на месяцы. Герметичные кислотные аккумуляторы потеряют за год всего 40% своего заряда, однако, если температура воздуха будет выше 20 градусов, процесс потечет куда быстрее, и наоборот, приближаясь к нулю – будет замедляться.
Более подробное строение элементов
Гальваническая батарейка в разрезе
Мы уже дали определение химических источников тока и назвали их основные типы. Теперь давайте рассмотрим немного глубже, как они устроены, и какие химические реакции внутри протекают.
- Итак, начнем с первичных гальванических элементов. В их состав входят реагенты (окислители и восстановители), которые участвуют в прямом преобразовании энергии. Выработка тока прекращается после того, как реагенты полностью израсходуются.
- В качестве примера того, как функционирует элемент, давайте опишем давно известное устройство Даниэля-Якоби. Выше представлена его схема.
- Итак, два электрода (цинковый и медный) опущены в колбы наполненные растворами сульфатов цинка и меди, соответственно.
- Растворы разъединены внутренней цепью (полупроницаемой перегородкой), а электроды соединяются внешней цепью (металлический проводник) через гальванометр, обозначенный на схеме как 2.
- Когда цепь замкнута, на обоих электродах протекают процессы гидратации ионов металлов. Между самим металлом и его ионами в растворе устанавливается химическое равновесие.
- В связи с тем, что цинк и медь имеют разную активность электродных потенциалов, электроды приобретают разный заряд по величине, то есть концентрация свободных электронов на них будет значительно отличаться.
- Как только будет замкнута внешняя цепь, концентрация электронов придет в равновесие и они по внешнему проводнику начнут перемещаться от цинкового электрода к медному.
- По этой причине концентрация электронов на цинковом электроде начинает уменьшаться, из-за чего происходит смещение равновесия на границе Zn|ZnSO4 в сторону катионов цинка (их образования). Другими словами цинк начинает растворяться.
- С медным электродом происходит обратный процесс – равновесие смещается в другую сторону и начинает образовываться металлическая медь, или другими словами – медь начинает восстанавливаться.
- Если говорить более конкретно, то на цинковом электроде происходит процесс окисления, который в электрохимии называется анодным процессом, а сам электрод – анодом. На медном электроде (катоде) – процесс восстановления, называемый еще катодным.
Классическая солевая батарейка
- Наиболее широко распространились элементы питания, состоящие из марганца и цинка. Они не содержат раствора электролита, поэтому называются сухими.
- Эти элементы при всем конструкционном многообразии делят всего лишь на два типа, в зависимости от рН электролита и состава: солевые и щелочные. Для солевых марганцево-цинковых элементов (МЦ) используется электрохимическая схема Лекланше (Zn|NH4Cl|MnO2) – в качестве катода выступает цинковый электрод, в качестве анода – электрод их диоксида марганца и графита, а электролитом является паста из муки или крахмала с раствором хлорида аммония.
- В щелочных элементах питания применяется другая схема (Zn|KOH|MnO2). При этом электроды делаются из тех же материалов, а в качестве электролита применяется паста из гидроксида калия.
- Такие элементы обладают большей емкостью, лучше переносят низкие температуры и высокие разрядные токи. Однако они намного сложнее солевых источников, почему и имеют значительно большую цену.
- Данные элементы имеют многоцелевое назначение и применяются в быту повсеместно. Они могут выступать источниками автономного питания для любой радиоаппаратуры, фотоаппаратов, калькуляторов, различных тестовых приборов, часов, фонариков, для запитки схем Биоса материнских плат персональных компьютеров и прочего.
Процесс зарядки аккумуляторных батарей
- Аккумуляторы, или вторичные химические источники тока – отличает эти элементы то, что благодаря воздействию внешнего тока, электрическая энергия может переходить в химическую, а при подключении внешней цепи происходит обратный процесс.
- Одним из часто встречающихся типов таких устройств являются свинцовые аккумуляторы, которые также называют и кислотными.
Источник: https://elektrik-a.su/teoriya/himicheskie-istochniki-toka-1132
Химические источники тока
Радиоэлектроника для начинающих
К химическим источникам тока причисляют гальванические элементы и аккумуляторы. Есть и другие химические источники тока, но они менее распространены. В обиходе гальванический элемент получил название батарейка. Это не совсем верное определение, так как батарейкой можно назвать несколько отдельных гальванических элементов соединённых вместе – это и есть батарея питания или батарейка.
Узнайте подробнее о правильном соединении элементов питания.
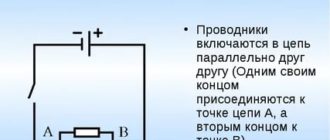
На принципиальных схемах гальванический элемент обозначается так.
Так обозначают один гальванический элемент или один элемент аккумулятора.
Но поскольку номинальное напряжение на одном гальваническом элементе обычно не более 1,5 вольта, их соединяют в батареи питания. Батарея питания на принципиальной схеме обозначается вот так.
Здесь показано, что батарея питания состоит из двух отдельных гальванических элементов. Общее напряжение на полюсах этой составной батареи — 3 вольта из расчёта, что каждый из элементов имеет на полюсах напряжение 1,5 вольта. Также на схемах можно встретить и такое обозначение.
Это тоже условное изображение батареи питания или батарейки на принципиальной схеме, только здесь не уточняется, сколько именно гальванических элементов используется в батарее, а указано лишь общее напряжение на полюсах батареи.
Одиночный аккумуляторный элемент обозначается на схемах так же, как и отдельный гальванический элемент. Номинальное напряжение одного аккумуляторного элемента обычно составляет около 1,25 вольт. Чтобы получить аккумулятор с большим напряжением аккумуляторные элементы соединяют вместе – получается аккумуляторная батарея или просто аккумулятор. Обозначение аккумуляторной батареи на схемах такое же, как и батареи, составленной из гальванических элементов.
Чем гальванический элемент отличается от аккумулятора?
Дело в том, что гальванический элемент сам является источником постоянного тока, который образуется за счёт необратимой химической реакции. Гальванический элемент причисляют к первичным источникам тока.
Аккумулятор является так называемым вторичным источником тока. Почему? Потому, что перед тем, как использовать аккумулятор, его нужно предварительно зарядить от источника постоянного тока — зарядника.
Только после полной зарядки аккумулятор сможет питать электронное устройство. Отличительным качеством аккумуляторов является то, что их можно заряжать и разряжать много раз.
В отличие от аккумулятора, гальваническая батарея питания после своего полного разряда не может быть использована повторно.
Какие существуют батарейки?
Наибольшее распространение в настоящее время получили щелочные батареи питания. Их ещё называют алкалиновыми – производное от английского слова alkaline – «щелочь».
Работа щелочной батарейки основана на окислительно-восстановительной химической реакции между цинком и диоксидом марганца. Результатом, а точнее полезным продуктом этой реакции является электрический постоянный ток и тепло, которое не используется. Электрическая ёмкость щелочной батарейки составлет около 1700 — 3000 мАч. По величине своей ёмкости, щелочные батарейки лидируют по сравнению с солевыми батарейками, электроёмкость которых меньше и составляет 550 — 1100 мАч.
Щелочная батарейка устроена следующим образом. Взглянем на рисунок.
Корпусом элемента является никелированный стальной стакан. Он же является плюсовым контактом батарейки «+». Активная масса представляет собой смесь диоксида марганца (MnO2) и графита.
Анодная паста – это смесь порошка цинка (Zn) и густого щелочного электролита. Электролитом обычно служит раствор гидроксида калия (KOH). Анодная паста отделена от активной массы сепаратором.
Сепаратор разделяет реагенты, исключая их перемешивание и нейтрализацию заряда. Также сепаратор пропитан электролитом.
Отрицательный потенциал снимается с латунного стержня, который окружён анодной пастой. Стальная тарелка контактирует с латунным стержнем – токосъёмником и является отрицательным контактом элемента «—».
Прокладка изолирует никелированный стальной стакан от стальной тарелки, препятствуя тем самым короткому замыканию. Кроме этого прокладка сдерживает давление газа, который в незначительном количестве образуется при химической реакции.
В толще прокладки имеется защитный клапан или по-другому предохранительная мембрана. Защитный клапан служат для того, чтобы при чрезмерном давлении газа сработать и выпустить его наружу. Это предотвращает взрыв щелочного элемента, но и приводит к его разгерметизации.
Как правило, разгерметизация приводит к течи электролита.
Иногда, забыв вынуть уже подсевшие батарейки, через некоторое время можно обнаружить, что в батарейном отсеке появилась какая-то жидкость. Это и есть потёкший электролит. Он может вызвать коррозию контактов. Поэтому на упаковке с батарейками можно найти предупреждение о том, что севшие элементы нужно вынимать из электроприборов. Теперь вы знаете, зачем это нужно делать.
Итак, с устройством разобрались, теперь поговорим о том, как работает щелочной элемент.
Как работает щелочной элемент
Для начала, маленькое отступление
Как вы заметили, почему то анодная паста соединяется с помощью токосъёмника с отрицательным контактом элемента – стальной тарелкой. А ведь анод – это «+». Получается нестыковочка
В чём тут дело? А дело в том, что в электронике есть один каламбур. По умолчанию, за направление тока в электрической цепи считается направление от плюса (анода) к минусу (катоду) – так повелось ещё с тех времён, когда электроника ещё зарождалась.
Но ведь электрический ток, как известно, это упорядоченное движение электронов, которые имеют отрицательный заряд. И поэтому, ток течёт оттуда, где есть избыток электронов, в направлении, где есть нехватка отрицательных зарядов (это и есть плюс – недостаток электронов). При этом получается, что ток течёт в реальности от отрицательного контакта к положительному. Именно поэтому образуется эта нестыковка, которая порой вводит начинающих радиолюбителей в ступор.
В электрохимии анодом принято считать тот электрод, на котором происходит процесс окисления. Так вот в щелочной батарейке (и не только) на аноде в результате окисления образуется избыток электронов. То есть по сути – это катод, «минус». Но, как уже говорилось, в электрохимии всё наоборот. Итак, электроны вырабатываются анодной пастой – смесью цинкового порошка (Zn) и густого электролита (раствора KOH).
Катодом же считается электрод, где происходит реакция восстановления.
Далее электроны, которые были получены в результате реакции окисления, проходят по электрической цепи электронного прибора, и возвращаются опять в батарейку, но уже на катод, где эти электроны используются для восстановительной химической реакции.
Катод – это диоксид марганца. Токоприёмником катода служит никелированный стальной стакан, который контактирует с активной массой – диоксидом марганца (MnO2).
Вот такая игра в наоборот. Напомню ещё раз, что в электронике за направление тока в цепи считается направление от плюса-«анода» к минусу-«катоду». В электрохимии всё наоборот. С этим и связаны особенности в названии реагентов химического источника тока.
Можно ли заряжать батарейки?
Также часто можно слышать вопрос: «Можно ли заряжать батарейки?» Ответим: «Лучше не стоит». Дело в том, что для вырабатывания электрической энергии в батарейках используется необратимая химическая реакция. Поэтому батарейка и является первичным источникам тока.
А вот в аккумуляторах используется обратимая химическая реакция, которая позволяет заряжать и разряжать их множество раз. Поэтому аккумуляторы и называют вторичными источниками тока.
Несмотря на это, известно, что щелочные элементы допускают перезарядку, т.е. их можно зарядить и использовать повторно. Но такие, перезаряжаемые щелочные элементы имеют свою особую конструкцию. Также стоит отметить, что даже такие элементы нельзя перезаряжать много раз, обычно не более 25. В широкой продаже такие щелочные элементы не встречаются. Их маркируют как Rechargeable Alkaline Manganese.
Из всего этого следует, что заряжать обычные щелочные батарейки категорически не стоит. Такие эксперименты могут завершиться взрывом батарейки и разбрызгиванием электролита. А это не есть гуд +опасно для здоровья .
Чтобы замедлить химическую реакцию в щелочном элементе и, тем самым, продлить срок её хранения и снизить саморазряд батареи, в них раньше добавляли кадмий и ртуть. Эти вещества замедляли химическую реакцию, и цинк окислялся медленнее. Но, из-за токсичности ртути и кадмия их сейчас не используют, а применяют другие, менее вредные ингибиторы.
На многих батарейках можно даже увидеть надпись – 0% кадмия и ртути или 0% Hg & Cd. Это своеобразный маркетинговый ход, как бы намекающий на то, что данные батарейки безопасны.
Если вы с успехом дошли до этих строк, то теперь вас можно поздравить, ведь теперь вы знаете, как устроена и работает щелочная батарейка. И поэтому её и не обязательно разбирать . Кроме щелочных элементов питания существуют и другие, но об их устройстве мы расскажем в другой раз.
» Радиоэлектроника для начинающих » Текущая страница
Также Вам будет интересно узнать:
- Собираем блок питания своими руками.
- Зачем нужен трансформатор?
Источник: https://go-radio.ru/ximicheskie-istochniki-toka.html
���������� ��������� �������
������� / �������� ���������� / ���������� ��������� �������
���������� ��������� ������� ������������� ��� �������������� ���� ����������� ���� � ����������.
� ����� ������ ������ ��� ��������������� �������������� �� ������� ����������, ���������� ��� ����� ���������� �� ��������� � ����������. �� ���������� �������� ������� ��������� ��� �������������� �� �����������. ��� ����������� ������������ ��� ��������� ���������, ��������� � ������� �������� ������ ������� ����������.
�������, ���������������� ���������� ��� � ����������, ���������� ����������� ����������� ������� ��� �������������. ��� ���������� ��� �� ������ �������� ���������� � ���������� � �������������� �� �������������.
��������� ������� ����������� ����������
��������� ������� ����������� ���������� �������������� ��: ����������� � �������������. � ����������� ������������ ����� ������ ���� ���� �� ������. ��� ����� � ����������� ��������� ��������, � ������� ��� ��������� ������������� �������� � ���� ����. ����� ����� ����� ������������ � ������������� �������� � �������� �����������.
� ������������� ���������� ������� ����������� ���������� ���� ���� ������ ��������� �� ������.
��������� ������� ������ � ���������������� � ������������� ���������������.
� ������ ������ ����� ������������� � �����������, ��� ������� ������� ����, �� ������ ���������� ��������������� ������������ ���������� � ���� ����.
�� ������ �������� � ����� ��������� ��� ���������� ��������: �� ����������� ������� ����������� ���� ����� ���������������. ��� ��������� ����������� ������� ����� ���������� � ��������� ��������� ��������� �������. �� ���������� ��������� ������� ��������� ��������� ����� ����� �����������.
��������� ������� ����������� ���������� ����� ����������� �� �������� �������� �����������. ���������� ����� ������ ���������� ������� �� ������������� (����������) �� ��������� (�����������), ����������� ��������� ��������� ������������� ������.
��������� ������� ����������� ������� �� 24 �
� ���������� ������� ����������� ������� �� 24 � �� ������ ������ �������������� ���������� � 24 �. ����� �������� �� ���������� �� ������ ������� ���������� � ����� �������������, ������� ������������ ������ ��������. ��� �������� �������� ������������ �������� ���������� ������ ����� ����������.
������ �������������� ��������� ������� ����������� ����
������ �������������� ��������� ������� ����������� ���� ���������� ��� ��������� ����������������� ����������, ������������ ������� ������, ����������� �����������, ��������� ��������� ������, �����������, �������.
������������� ������������ � ������ ����� ������������ �������� ���������� ��������� ������� �������, �������� ������� ����� ��������� 40 ���.
��-�� ������� ���������� �������� � ���� ������ ������� ����������� ���������� ���������� � ����� ������� ������ ���� �� ���������� � ��������� ���������.
����������������� �������� ������� ����������� ����
����������������� ��������� ������� ����������� ���� ������������� ��� ������������� ������� ����������� ���������� �����, ���:
- ����������;
- ����������;
- �������� ���������� ������� ���������.
������������, ��� �������� ���������� ����������������� ��������� ������� ����������� ����, �� ������� �������� ��������� � ���� ����, �� ��� ��� ���������� �������� ������������ � �������������� ���������� ���������� �� ������ �������. ������� �������� �� �������� ���������� (����������, ���� ����) ������������������ ��������� ������� �������� �����������������.
� ����� ����� ����������� ����������� �������� �����, ��� �����������, ������������, ���������. ��� ���������� ���������� ��� ���������� �� �������� ������.
��������� ������� ��������� ���� ����������� ����
��������� ������� ��������� ���� ����������� ���� ���������� �� ���������� ���, ��� � ����� ������������ �������� ���� ���� � ���������� �������� � ����������� �� ��������� ��������� ����.
�������, ����� ������� �������� �������� � ����������� �������, ��������� �������� ����� �������, ��� �������� ���������� ��������� ������������ ��������, � ���� ���� �����������. ��� ������������ ����������� ������� ����������� ����� ���������� � �������.
�� ���� ����� ����������� ����, � ������� ��������� ��������� ��-�� ������� ����������� ������� �� ���� �������� ���������� � ���������� ���������� ������. � ���� ������ ���������� �������� ������, � ���� ���� �����, ������� ������� �������������� ������. ���� ������� ���������� ��������� ���� ���������� � �������� ������������������.
������������� � ���������� ���������� ����������� �������
����� �������������� ���������� ����������� ������� ����� ��������:
- ����� ����ϻ (������������������ ����������), �. ������ ��������;
- ��� ���������+� (������������� �������� ������� ����һ), �. ������;
- �� ������-�������, �. �������.
������������ �� ����� ����� ������� ����� ����, ��� �������. ������� �� ������ ������� ���������� ����������� ������� ��������� ����� ������. ������ ����� �������� ����������� ����� �����. ��������� ���� �������� ����� �������� � ����������� ������� � �����������.
��������, ��� ���ʻ �������� ����������� ��������� �������� EATON, ������������������ �� ��������� ���������������� � ���������� �������������� �������.
������ � ���������� ������� ����������� ���� � ���������� ����� ������ �� �������� ��������.
������� ������ ���� ������:
������� ����������
�����������������
����� �������������� �������
Источник: https://www.elektro-expo.ru/ru/ui/17167/